اکثر فناوریهای امروزی از طبیعت الهام گرفتهاند. سطوح خودتمیزشونده با کشف ریزساختار برگ نیلوفر آبی، که برخلاف ظاهر صافش در مقیاس میکرو زبر است، مورد توجه قرار گرفتند.

کاشی های خود تمیز شونده
پدیده خودتمیزشوندگی به زاویه تماس بستگی دارد و بر این اساس، سطوح خودتمیزشونده به دو دسته ابرآبدوست و ابرآبگریز تقسیم میشوند. زاویه تماس در فصل مشترک سه فاز جامد و مایع و گاز در محل تماس قطره مایع با سطح جامد تشکیل می شود. به طور کلی، اگر زاویه تماس کمتر از ۹۰ درجه باشد، سطح را آب دوست می گویند، در حالی که اگر این زاویه بیشتر از ۹۰ درجه باشد، سطح را آب گریز می نامند. سطوح با زاویه تماس نزدیک به صفر درجه ابر آبدوست و سطوح با زاویه تماس بیشتر از ۱۵۰ درجه ابرآب گریز نام دارند. سطوح آب گریز دارای انرژی سطحی بسیار پایین هستند، در حالی که انرژی سطحی سطوح آب دوست بسیار بالاست. استفاده از فناوری نانو و بروز خواص متفاوت در ابعاد نانومتری دست یابی به سطوح ابر آب گریز و ابر آبدوست را ممکن کرده است.
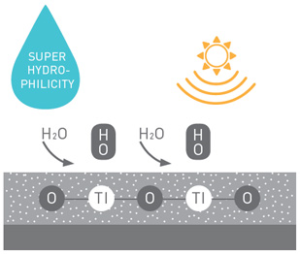
برخلاف سطوح ابرآبگریز که فقط از سازوکار جریان قطرات آب برای اثر خودتمیزشوندگی استفاده میکنند، سطوح ابرآبدوست با فرایند فوتوکاتالیز ساختار شیمیایی آلودگیها را در مجاورت نور خورشید از بین میبرند؛ اما بهعلت آسانی فراوری ساخت و در دسترسبودن امکانات، سطوح ابرآبگریز امروزه بیشتر مورد توجه قرار گرفتهاند. تولید سطوح ابرآبگریز به دو روش کلی ایجاد زبری در یک ماده با انرژی سطحی پایین و اصلاح یک سطح زبر با یک ماده با انرژی سطحی پایین انجام میگیرد.
در پوشش های آب گریز، آب به محض تماس با سطح به شکل قطرات کروی تجمع و از روی سطح لغزیده و ذرات آلودگی را با خود از روی سطح می زداید. زمانی که یک سطح دارای بافت زبری در مقیاس نانومتر باشد، فصل مشترک بین هوا و آب در یک قطره که بر روی سطح قرار گرفته است افزایش پیدا می کند و نیروی موئینگی بین قطره و سطح شدیدا کم می شود. بنابراین، قطره آب شکل کروی به خود می گیرد و به راحتی جریان پیدا می کند و ذرات آلاینده ی موجود بر روی سطح، به قطرات آب چسبیده و با غلطیدن قطرات آب، آلودگی ها نیز از سطح زدوده می شود. برخلاف سطوح آب گریز که فقط از سازوکار جریان قطرات آب برای اثر خودتمیزشوندگی استفاده می کنند، سطوح آب دوست ساختار شیمیایی آلودگی ها را در مجاورت نور از بین می برند.
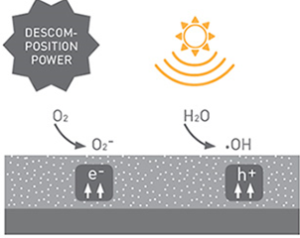
اکسیدهای جامد نیمهرسانا که با جذب فوتونها (درحضور نور) ، یک جفت الکترون – حفره در آنها ایجاد می شود و این الکترون – حفره با مولکولهای موجود در سطح ذرات واکنش می دهد، فوتوکاتالیزور گفته می شود.
TiO2
در سال 1972، محققان ژاپنی فوجیشیما و هوندا قابلیت های نیمه هادی دی اکسید تیتانیوم، TiO2 را در شکافتن آب در یک سلول فوتوالکتروشیمیایی نشان دادند. کار آنها انقلابی را در دنیای تحقیقات نیمه هادی ها ایجاد کرد. در ادامه فرانک و بارد در سال 1977 خواص منحصر به فرد دی اکسید تیتانیوم را برای اصلاح زیست محیطی از طریق کاهش سیانید در آب نشان دادند ] [1-4 و اولیس در سال 1983 آلاینده های آلی را به وسیله ی TiO2 کانی سازی کرد. [5-7 در دهه 1990، به دنبال مقاله Graetzel در مورد سلول خورشیدی حساس به رنگ، TiO2 به یکی از مواد نیمه هادی بین المللی تبدیل شد.
تمیز شونده
تمیزشونده

